

Diels−Alder反應於1928年首次報道,並於1950年獲得諾貝爾化學獎,是有機合成化學中最重要的反應之一。傳統的Diels−Alder反應發生在共軛二烯與烯烴之間,是合成六碳環的重要方法🍼。然而👩❤️👨,兩種不同共軛二烯之間的交叉Diels−Alder反應由於周環選擇性(periselectivity)的問題🫄🏻,會同時發生正電子需求和反電子需求的Diels−Alder反應,且區域選擇性👩🦽、立體選擇性也往往較差,大大限製了其在合成中的應用。從合成的角度上看,若交叉Diels−Alder反應的周環選擇性、區域選擇性和立體選擇性等一系列問題能得以克服,那麽它將成為傳統Diels−Alder反應的重要補充🧚🏼♀️。然而,選擇性的交叉Diels−Alder反應十分具有挑戰性✌🏽,是目前Diels−Alder反應研究領域的一個難點問題。

圖1📅:傳統Diels−Alder反應與交叉Diels−Alder反應
沐鸣开户蔡泉青年研究員團隊自2017年建立課題組以來,一直致力於利用2-吡喃酮這種特殊的雙烯體發展不對稱反電子需求的全碳Diels−Alder反應。近期👥,該團隊與來自加州大學洛杉磯分校、杭州師範大學的合作者在《自然•催化》(Nature Catalysis)在線發表了題為“具有‘兩可’反應模式的不對稱交叉Diels−Alder反應及合成應用(An enantioselective ambimodal cross-Diels−Alder reaction and applications in synthesis)”的研究論文👨🏭♿。
在該項研究中,蔡泉研究團隊利用2-吡喃酮與非活化1,3-共軛二烯發展了一種罕見的具有‘兩可’反應模式的不對稱交叉Diels−Alder反應🐀。在二價銅和手性噁唑啉配體的催化下,3-酯基-2-吡喃酮與多種取代的環戊二烯、環己二烯、富烯能發生高周環選擇性、高對映選擇性的不對稱交叉Diels−Alder反應🧕🏻,發散性地合成系列六元環外帶有額外雙鍵的順式並環結構。這種重要結構的合成過去需要通過Diels−Alder反應、1, 2-加成、3, 3-sigma重排等多步反應才能實現,且反應條件通常較為劇烈。利用該方法,研究者通過選擇合適的環狀共軛二烯底物,在溫和的反應條件下生成高度官能團化的關鍵手性中間體🙋🏽,從而以簡短的合成路線分別實現了抗瘧藥物青蒿素和植物生長調節劑冠菌素的高效形式不對稱全合成🐋,為這些重要活性分子的結構改造提供方法學和合成路線基礎🐔。
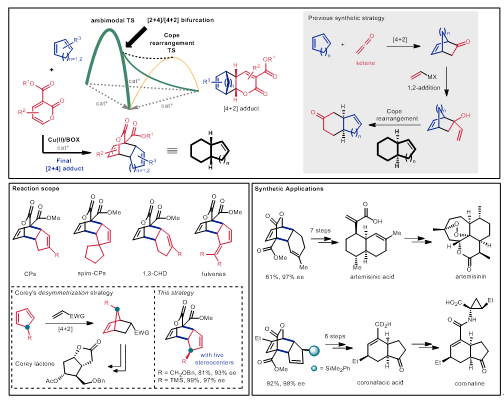
圖2:不對稱交叉Diels−Alder反應
為了理解該對稱交叉Diels−Alder反應的周環選擇性和對映選擇性調控機製,蔡泉研究組與加州大學洛杉磯分校的理論計算化學家K. N. Houk教授、加州大學洛杉磯分校/杭州師範大學的楊麗敏副教授合作,通過對照實驗和密度泛函理論計算的手段研究了反應的歷程和機理。研究的結果表明,該反應具有一種特殊的“兩可”反應模式,即:反應經歷一種ambimodal過渡態(“兩可”過渡態),同時得到 [4+2](正電子需求)和[2+4](反電子需求)的環加成產物🐦🔥。由於這兩種產物的形成經過了相同的過渡態,因此它們具有相同的絕對構型和ee值。隨後,這兩種環加成產物通過Cope重排反應過渡態相互轉化,最終得到熱力學穩定的反電子需求的環加成產物🫷🏿。
https://www.nature.com/articles/s41929-021-00687-x





